摘要:采用一种古老苹果品种的果实建立起植物细胞培养体系。萃取这些植物培养细胞于角
质形成细胞的原细胞上进行测试。发现该萃取精华大大的提高增殖细胞的形成效率,明显加强干
细胞的特征。使用含2%此苹果萃取精华的膏霜,对20名志愿者进行4周多的临床试验。经过测试
发现,使用该膏霜大大地减少眼角皱纹的深度。并且从测试前后的数码照片可以看出,它对皮肤
平滑度起积极作用。
简介
谈及皮肤干细胞,我们指的是成人干细胞。它们是存在于大多数组织中的自我再生类型的细
胞,可以形成一个或多个其它类型的细胞,发展成为分化的、成熟的组织细胞。成人干细胞的作
用是维护和修复组织。相比胚胎干细胞能够分化成身体所有类型的细胞,成人干细胞则通常受限
制,这意味着它们只能生成其所在组织的细胞类型。但也有许多报道说,根据适当的实验条件成
人干细胞可以分化成不同类型的组织。利用成人干细胞进行组织再生已成为医学研究人员关注的
焦点。由于皮肤干细胞容易获得,人们对此特别的感兴趣。干细胞也成为化妆品中的热门话题。
Amatokin——沃斯(Voss)实验室的一个脸部护理产品系列,声称可以激发皮肤中的干细胞。另
外,迪奥的CAPTURE R60/80 XP range抗皱产品,其机制是基于保护干细胞的活力。从皮肤脱水、
损伤和感染等方面对身体进行保护。由多层覆盖表皮的基底膜隔开,皮肤包括真皮层。真皮层的
中胚层是胚胎起源,并包含了成人干细胞的成纤维细胞间质。这些细胞具有多系分化潜能,也能
形成脂肪组织或骨骼。分层表皮是外胚层来源,组成的角质细胞分化成不渗水的角质层。本文的
重点是表皮成人干细胞,因为原料的局部应用主要影响表皮,表皮相比真皮更具表征特点。表皮
的最终分化细胞从皮肤中脱落,这就迫使不断地提供新分化细胞。表皮大约每4个星期完全更新一
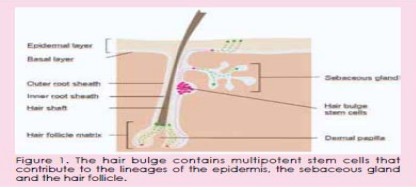
次。鉴于分化的细胞不能再分裂了,其替代就取决于表皮干细胞。有力的证据表明,头发隆起形
成一个表皮干细胞囊(图1)。干细胞定期迁移到表皮内卵泡(见粉红色虚线)中的毛囊,皮脂腺
和基底层,生成分化前的毛发细胞或表皮层细胞(见绿色虚线)。
household and Personal Care today - n 1/2009 - Focus on Anti-aging & Beauty inside 1
表皮的基底层含有两种不同类型的细胞群(图2 ):(一)慢分裂表皮干细胞和(二)迅速
化成的新细胞(该细胞以提供或取代经脱皮丢失的细胞)即其后代。
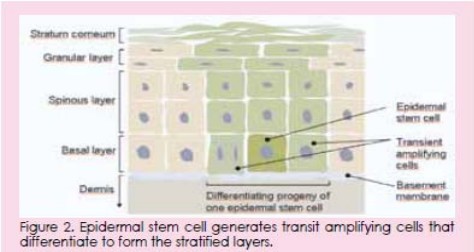
经过一定量的分化后,它们从基底膜分离,并开始其分化进程,最终形成角质层细胞。最新
研究表明,干细胞可能包括2-7%的基底层细胞。干细胞尽量保持其未分化状态,这种状态主要由
利基传出的信号及外成控制。利基由相邻细胞组成,以区分细胞,并提供一个特定的微环境。 外
成在基因表达上变化的机制:不是通过脱氧核糖核酸序列,而是根据脱氧核糖核酸和组蛋白的修
改控制(3)。事实上,表皮干细胞的自我更新缓慢是很重要的,因为它们分化至一定程度后死亡,
而每一次的分化都承担着致命的DNA突变风险。迄今,失去干细胞是比失去分化细胞更不利。
植物干细胞分两个种群,枝条顶端分生组织和根顶端分生组织,从而形成了完整的植物体。
类似于哺乳动物干细胞,植物干细胞的维持也是取决于微观环境的信号和类似的后生控制( 4 )。
植物组织培养技术是基于植物干细胞的繁殖,通过组织或单细胞培育获得完整的植物。当植物不
育和独立于季节和其他环境制约等标准化条件的情况下,就可以应用此方法进行植物培育生长。
植物组织培养几乎适用于所有的植物组织。从植物中得到的用来培养的组织材料,称之为前植株。
类似于创伤反应,新细胞在前植株的切剖面开始形成。这些细胞慢慢分化,形成无色的细胞团,
即所谓的愈伤组织。这些细胞分化成的细胞,缺乏正常植物细胞特性。在茎尖部分愈伤组织细胞
就类似于干细胞。为了大量生产产品,愈合组织在细胞暂停匀化后可培养在液体培养介质中。
Uttwiler Spätlauber苹果是一古老品种,被用来获取组织前植株,以进行培养植物干细胞。
苹果树被种植因为它具备优异的存储特性。该Spätlauber品种来自于瑞士种植在18中世纪的植株。
Uttwiler Spätlauber干细胞在生物反应器中的液体培养已获得成功(5)。提取这些苹果干细胞进
行一系列的测试,以研究其在皮肤中的抗衰老功效。
实验部分:植物细胞培养
Uttwiler Spätlauber品种的苹果被选择为合适的植物原材料,再根据标准方法进行愈伤组织
的诱导和独立栽培。(植物细胞培养:用一种实用的方法,Ed P. A. Di xon, 1 9 9 4 ,牛津大
学出版社)。在适当的液体介质中,根据标准程序进行分化细胞团的培养,其中包括悬浮液中的
匀化细胞和追踪性的细胞。10%以上的完全生长细胞培养悬浮液被用作接种。生产的生物量置于
50-100L的一个特殊生物反应系统(Wave-Biotech AG,Tagelswangen,,瑞士)。培养条件设置
为25℃和通气率0.1vvm 。不同培养群使用各自摇摆速度( 20转/分钟)和摇摆角度 ( 8.5 - 9 ° ) 。
生物质生产通过分析总糖浓度、电导率、pH值和光密度等进行监控。生产二次代谢产物紧接着进
行的是高效液相色谱法和紫外/可见分析。
化妆品成份的生成
Uttwiler Spätlauber干细胞提取物在赖氨酸于植物细胞高压均质后获得。统一化妆品品名为
“PhytoCellTecTM Malus Domestica”,该提取物用卵磷脂脂质体包覆PhytoCellTecTM Malus
Domestica的组成如下(INCI):苹果干细胞萃取液,黄原胶,甘油,卵磷脂,苯氧乙醇和水。
结果与讨论: 对表皮干细胞的作用 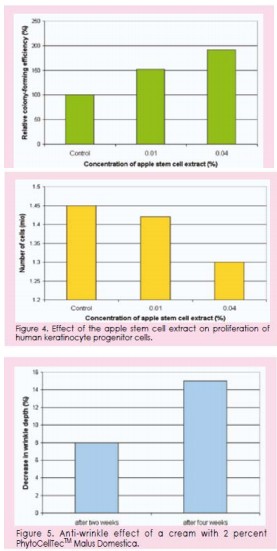
苹果中干细胞提取物在体外第一次测试
是针对表皮干细胞。一种新型的原始细胞定位
技术被用来制造人类表皮干细胞。 该方法主
要包括在的模拟体内干细胞利基的微环境培
养基中培养人类的角质形成细胞。 特别的是,
完全限定细胞培养基使丰富的角质形成细胞
的祖细胞,可定性为被激活的干细胞。比较刚
分化的细胞,通道4的细胞族群标志为放大10
倍的CD34/ alpha6整合双标记细胞(1)。这些
角质形成细胞原始细胞在苹果干细胞产品中
被孵化,群体形成率(CFE)在不同的细胞通道
是一定的。
对CFE进行分析,细胞在低浓度条件下繁
殖。增殖细胞数量因原始细胞(干细胞)浓度
值的不同而异,因为分化后的角质细胞已经失
去分化能力和瞬间分裂放大形成角质形成细
胞的能力,所以不能生成增殖细胞。
相对于空白水平,在含0.4%植物干细胞
为主要成分的条件下,CFE的刺激率高出100
%(图3 )。这清楚地表明,苹果干细胞产品
可有效维持表皮干细胞的干细胞特性。
使用苹果干细胞产品后,细胞的增殖减少
(如图4)。这表明在较高比例的苹果干细胞产
品中表皮干细胞的分化减慢。
在眼角鱼尾纹区域的抗皱效果
苹果干细胞提取物作为化妆品成分的功
效在一次20名女士(年龄37~64岁)超过4周的
临床试验中得到证实。测试的产品是用含2%
的PhytoCellTec Malus Domestica膏霜 ,此膏霜是正常的水包油乳化体。将该产品每日两次涂在
眼角鱼尾纹区域。皱纹深度分别在2个和4个星期后使用PRIMOS系统分析所得。皮肤快速、较少接触3D测量装置,皮肤表面被直接测评。对开始前和使用后的眼角鱼尾纹区域的数码照片进行了研
究。发现使用含2%的PhytoCellTec Malus Domestica膏霜在2个和4个星期后,皱纹的深度分别
明显减少了8%和15%(Figure 5)。效果由3D图象很好地显示。如Figure 6所示。在数码照片中同样
显示其抗皱效果。

结论
成人干细胞是重建组织的源泉。快速再生组织如表皮就是依靠它们。成人干细胞不是长存的,
因为他们只可接受有限次的细胞分裂。更重要的是,成人干细胞保持着干细胞的特征。皮肤干细
胞丧失活性直接导致了再生潜力的降低和最后皮肤老化的现象。苹果干细胞提取物可改善维持表
皮干细胞的干细胞特性,其对皮肤抗衰老的功效,在一次临床实验中得到证实。确切的作用机制目
前尚不清楚,但苹果干细胞提取物是皮肤返老还童的一种承诺。
References and notes
1. F.M. Watt, C. Lo Celso et al., “Epidermal stem cells: an update”, Current Opinion in Genetics
& Development, 16, pp. 518-524 (2006).
2. L . Alonso, E. Fuchs, “Stem cells of the skin epithelium”, pnas, 100, pp. 11830-11835 (2003).
3. M . Spivakov, A.G. Fisher, “Epigenetic signatures of stem-cell identity”, Nature Rev Genet., 8,
pp. 263-271 (2007).
4. M .E. Byrne, C.A. Kidner et al., “Plant stem cells: divergent pathways and common themes in
shoots and roots”, Current Opinion in Genetics & Development, 13, pp. 551-557 (2003).
5. C . Schürch, P. Blum et al., “Potential of plant cells in culture for cosmetic applications”,
Phytochem Rev., 7, pp. 599-605 (2008).